Объектом пристального внимания в последнее время стали микроорганизмы Нelicobacter pylori (HP), открытые в 1982 г. австралийскими исследователями В. Marshal и S. Warren. Они впервые высказали мысль о том, что бактерии, обнаруженные на слизистой оболочке желудка, не сапрофиты, а истинно патогенные, повреждающие поверхностный эпителий. В 2005 г ученые за свое открытие получили нобелевскую премию.
Примерно 60% населения планеты инфицированы НР.
В диагностическом отделении "Международного центра охраны здоровья" вы можете пройти полное обследование на наличие данной ифекции в организме. У нас проводится эндоскопическая диагностика: гастроскопия с биопсийным анализом на наличие Нelicobacter pylori (HP). В отделении гастроэнтерологии проводит прием очень опытный специалист, врач гастроэнтеролог, который может назначить лечение и дать свои рекомендации в случае необходимости.
Узнать стоимость услуг эндоскопии, лабораторной диагностики и консультации гастроэнтеролога можно в соответствующем разделе прайс-листа на нашем сайте.
В развивающихся странах до 90 %, а в высокоразвитых не более 30-50 %, что говорит о том, что интенсивность эпидемиологического процесса определяется общим социальным и гигиеническим уровнем населения. По мнению Graham D.I. – НР это самая часто встречающаяся инфекция человека. Путь передачи инфекции орально-оральный, фекально-оральный. В настоящее время имеются научные доказательства связи инфекции с хроническим гастритом, язвенной болезнью желудка и 12-перстной кишки, злокачественными опухолями желудка (аденокарциномой и экстранодальной В-клеточной лимфомой).
Каждый 10 взрослый в России страдает тем или иным заболеванием органов пищеварения (Григорьев А.П.).
Интерес практических врачей к данной инфекции стимулирует появление и дальнейшее усовершенствование методов ее диагностики, на основании обнаружения которой будет построен оптимальный выбор схем для лечения.
НР – грамотрицательные палочки, спирально изогнутые в различной степени, длина варьирует от 1,5-5 мкм, ширина от 0,3 до 1,0 мкм. Палочки с закругленными концами, высоко подвижные, благодаря наличию полярно расположенного жгутика, либо нескольких. В старых культурах образуют сфероидные или кокковидные формы (В.В.Меньшиков, 2003г). Однако, при пападании в благоприятные условия, кокковидные формы вновь приобретают способность к трансформации в вегетативные формы (Д.А.Аникеев, А. А. Нижевич, Р.Ш.Хасанов, 2001г).
НР не является облигатным патогеном, т.е. инфицирование не всегда сопровождается развитием выраженного заболевания.
Методы исследования
Большое количество методов выявления инфекции, создает определенные трудности для врачей-клиницистов и врачей КДЛ в выборе адекватных и достоверных способов ее диагностики. Постулат «Диагностика должна быть комплексной» не ясен – а что же должно входить в этот комплекс? Комплекс методов или метод должен четко решать задачи:
- выявление НР;
- выбор эффективной схемы лечения;
- оценка эффективности проведенного лечения.
Применяемые сегодня методы диагностики имеют свои преимущества и недостатки, поэтому ограничиваться «монодиагностикой» нельзя. «Монодиагностика», особенно первичная, неизбежно приведет к ошибкам как в сторону гипердиагностики (при серодиагностике сыворотки крови – вследствие перекрестного реагирования АТ, при уреазном тесте – из-за контаминации бактерий, обладающих уреазной активностью, при гистологическом исследовании – из-за схожести морфологии ряда микроорганизмов), так и в сторону гиподиагностики (из-за сложностей культивирования НР, при гистохимическом – в случае низкой обсемененности, не попадании в гнездо, при уреазных тестах – из-за снижения уреазной активности НР). Следовательно, успешность диагностики НР зависит от правильного сочетания различных методов (т.е. комплекса методов) и сопоставления полученных данных. Эти положения в полной мере справедливы и в отношении оценки эффективности лечения инфекции.
Успешное лечение НР во многом зависит от правильного выбора лекарственного препарата, поэтому перед началом анти-НР терапии необходимо располагать сведениями о чувствительности НР к химиотерапевтическому препарату. Эта проблема стала актуальной в связи с выявлением резистентности НР к ряду антибактериальных препаратов. Наибольшую тревогу у клиницистов во всем мире вызывает резистентность НР к метронидазолу и кларитромицину.
Все существующие методы диагностики НР можно разделить на прямые и косвенные. Прямые методы позволяют непосредственно выявить НР. Косвенные – регистрируют последствия персистирования НР в организме особенно первичная, неизбежно приведет к ошибкам как в сторону гипердиагностики (при серодиагностике врачей КДЛ в выборе адекв
Можно так же разделить методы определения НР на инвазивные и неинвазивные.
Инвазивные методы
В качестве исследуемого материала, используют биоптат слизистой оболочки желудка, который может быть получен при эндоскопическом исследовании (Л.М.Муштоватова, 2003г). Учитывая гнездовую локализацию НР в слизистой оболочке, пробы берут одномоментно из нескольких точек, исключая дно эрозии или язвы, а так же края, так как здесь отсутствует слизь, а значит и НР, находящиеся под ее защитой (Л.Г.Баженов, 1991г).
Гистологический метод.
Получил широкое распространение, так как позволяет одновременно с обнаружением НР проводить морфологическую оценку состояния слизистой желудка, что является преимуществом этого метода. Гистологический метод – это «золотой стандарт» диагностики инфекции. Чувствительность метода 72-100%, а специфичность 81-97%. Это прямой метод выявления бактерий.
Цитологический метод.
Готовят мазки – отпечатки, которые окрашивают по Романовскому-Гимзе. НР при этом окрашиваются в темно-синий цвет и хорошо видны как на поверхности эпителия, так и в глубине желудочных ямок. Наличие масляной эммерсии значительно повышает выявляемость микроорганизмов и позволяет обнаруживать их классическую конфигурацию
в виде « летящей чайки» или в виде буквы S или C. Минусы: Оценка в плане степени обсеменения ориентировочная, т.к. эндоскопист мог и не попасть в место гнездования. Нет информации о структуре слизистой оболочки желудка. Кокковидные формы НР могут дать ложноотрицательный результат.
Плюсы: Быстр в исполнении. Чувствительность 90 %, специфичность 100%.
Цитологический метод в желудочном соке, полученном натощак, имеет низкую чувствительность и специфичность, в настоящее время не применяется.
Бактериологический метод.
Дает возможность культивировать НР, используя биоптаты слизистой оболочки желудка. Однако исследования очень трудны, т.к. НР крайне чувствителен к высушиванию и/или высоким концентрациям кислорода. Процесс культивирования очень трудоемкий и требует длительности получения конечных результатов.
Минусы: Сложность и дороговизна выполнения ограничивают применение метода, несмотря на неоспоримые преимущества.
Серологические.
Агрессия НР и колонизация слизистой оболочки желудка вызывает системный иммунный ответ. В результате которого у больного появляются АТ Ig A, IgG, IgM против различных бактериальных антигенов, которые могут быть выявлены серологическими методами.
Самым распространенным серологическим методом является ИФА. Метод неинвазивный и косвенный – в крови больного определяют антитела к НР. Чувствительность данного метода 87-98 %, специфичность около 75-100 %. В настоящее время в распоряжении клинической лабораторной диагностики имеются наборы для серологического анализа, позволяющие оценивать патогенность штаммов НР. Такие штаммы характеризуются наличием гена Cag A, на основе которого продуцируется цитотоксический белок. Метод ИФА позволяет обнаружить АТ к этому белку в крови больных. Диагностическая чувствительность тест-систем для обнаружения АТ к белку Cag A НР составляет 90-100 %, специфичность – 76-90 %.
При обнаружении АТ к НР, проводят количественное исследование. На основании снижения титра антител после проведенной терапии судят об эффективности подобранной антибиотикотерапии.
Очень распространены стали экспресс-тесты АТ Ig. Время выполнния 10 минут.
Другим высокоспецифичным методом диагностики НР инфекции является Western-blot – встречная преципитация в геле АТ сыворотки крови больного с различными белками НР, меченными зондами, подвергнутыми разделению по молекулярной массе с помощью электрофореза и нанесенными на нитроцеллюлозу.
Недавней разработкой являются качественные тесты для определения АТ к НР, которые можно выполнить « у постели больного». Они основаны на латекс-агглютинации или твердофазного ИФА и выявляют антитела IgG к НР. Для проведения исследования нужна капля крови, взятая из пальца больного, результат считывается через несколько минут, дополнительных реактивов не нужно. Диагностическая чувствительность 94 %, специфичность – 94 %.
В 1998 году появились тест-системы для количественного определения антигена НР в фекалиях больных методом ИФА, которые имеют большие перспективы. Диагностическая чувствительность 88,9 %, специфичность – 96,4 %.
Полемеразно-цепная реакция (ПЦР)
Современные подходы к диагностике инфекции НР включают методы исследования, которые представляют различные модификации ПЦР с обнаружением генетического материала, специфического для НР. (162-рРНК).
Метод ПЦР позволяет амплифицировать фрагмент ДНК и в считанные часы размножить in vitro специфический участок ДНК (т.е. любой интересующий ген ) более чем в 200 000 раз. Уникальность метода ПЦР состоит не только в высокой чувствительности и специфичности для диагностики НР, но и в том, что материалом для него являются биоптаты СОЖ, и желудочный сок, и смывы ротовой полости, и зубной налет, и копрофильтраты. Диагностическая чувствительность ПЦР метода составляет 88,0-95,4 %, специфичность – 100 %, в копрофильтратах 61,4-93,7 % и 100 % соответственно.
«Аэротест»
Автоматизированный метод, основанный на высокой эндогенной уреазной активности хеликобактеров. Мочевина, транссудируемая из плазмы крови в слизистую оболочку, расщепляется экстрацеллюлярной уреазой НР до аммиака. Образующийся аммиак измеряют (линейно-колористическим методом) в воздушной среде ротовой полости пациента. При выполнении «аэротеста» интегрируется ответ всей слизистой оболочки желудка, а не ограниченного участка (биоптата) (В.В.Меньшиков, 2003).
Аналогичный метод «Хелик-тест» (г.С-Петербург) основанный на кинетической оценке концентрации аммиака в воздухе полости рта, после приема карбамида (500мл) обычного углеродного состава. Этот метод советуют применять детям, где исключена возможность инвазивных методов исследования.
Чувствительность 90-100%, специфичность 30-36 % (вероятность ложноположительных результатов). Диагностическая эффективность 63-65%, т.е. можно использовать для исключения наличия НР, а для подтверждения требуется использование других методов.
В нашей клинике при проведении эндоскопического исследования в обязательном порядке проводится исследование биоптата тест-системой ХЕЛПИЛ (бланк) – экспресс-диагностика хеликобактериоза. Основан на изменении цвета индикаторного диска при при размещении на нем биоптата слизистой оболочки желудка. При наличии в биоптате уреазной активности на поверхности индикаторного диска появляется цветовое пятно с оттенками синего цвета.
Из лабораторных методов исследования рекомендуем метод ИФА. Метод точен, быстр, забор крови производится из вены натощак. Снижение титра антител позволяет судить об эффективности проведенной терапии.
«Экпериментальная и клиническая гастроэнтерология», 2009, №2, с.50
Барышникова Н.В.
Санкт-Петербургская государственная медицинская академия имени И.И. Мечникова
Хеликобактериоз — одна из наиболее серьезных проблем гастроэнтерологии в связи с тем, что распространенность инфицирования Helicobacter pylori прогрессивно возрастает, данное заболевание все чаще выявляется у людей молодого трудоспособного возраста, а также с тем, что данный микроорганизм признан канцерогеном первого порядка. Следовательно, разработка алгоритмов ранней и точной диагностики хеликобактериоза позволит улучшить качество лечения и диспансерного наблюдения данной категории пациентов. Кроме того, все большее внимание уделяется проблеме реинфекции, в связи с тем необходимо уточнение сроков проведения контрольных тестов на H. pylori для дифференцировки реинфицирования и неуспешности эрадикационной терапии.
Несмотря на то, что Маастрихтским соглашением III в качестве рекомендуемых методов диагностики H. pyloriутверждены дыхательный тест с мочевиной, меченной 13С, и иммуноферментный анализ H. pylori в кале [1], существование большого количества различных методов диагностики инфекции H. pylori подтверждает постулат о том, что уникального метода, так называемого «золотого стандарта», для диагностики хеликобактериоза пока не существует. Все многообразие методов диагностики данного микроорганизма можно разделить на инвазивные (требуют проведения фиброгастродуоденоскопии) и неинвазивные (не требуют проведения фиброгастродуоденоскопии), прямые (определение собственно H. pylori) и косвенные (определение продуктов жизнедеятельности H. pylori). Основные и наиболее часто используемые методы диагностики хеликобактериоза представлены в таблице 1.
Таблица 1.
Методы диагностики инфекции Helicobacter pylori
|
Инвазивные методы |
Неинвазивные методы |
|
А) бактериологический метод |
А) серологический метод (скрининг) |
|
Прямые |
Не прямые (косвенные) |
|
А) бактериологический метод |
А) быстрый уреазный тест (Хелпил-тест) |
Инвазивные методы, как правило, используются при прохождении пациентом комплекса первичных диагностических мероприятий, т.к. в данном случае назначение фиброгастродуоденоскопии является обязательным. Потенциальные показания для использования неинвазивных методов несколько шире. К ним относятся скрининговое обследование взрослых, обследование детей с жалобами на периодическую абдоминальную боль, оценка успешности эрадикации, научные показания (оценка распространенности инфекции, изучение ассоциации между наличием H. pylori и экстра-пищеварительными нарушениями) [2].
Как уже упоминалось выше, ни один метод диагностики H. pylori нельзя считать универсальным. Каждый метод исследования H. pylori имеет свои преимущества и недостатки, методы различаются по чувствительности и специфичности. Во время проведения многочисленных сравнительных исследований установлено, что результаты различных методов не всегда идентичны, следовательно, чтобы избежать получения ложнонегативных или ложнопозитивных результатов, для более точной диагностики наличия инфекции необходимо использовать как минимум два метода и результат считать положительным или отрицательным при совпадении показателей обоих методов исследования. Некоторые авторы рекомендуют даже использование трех методов для того, чтобы говорить об отсутствии инфекции [3].
К наиболее достоверным методам идентификации микроорганизма традиционно относятся бактериологический, гистологический и молекулярно-генетический методы.
Бактериологический (культуральный) метод является одним из наиболее информативных и специфичных методов. Специфичность его составляет практически 100%, чувствительность более 90% [2, 4]. Основу метода составляет культивирование микроорганизма на специальных питательных средах при определенных температурных условиях. Преимуществом метода является то, что он обеспечивает возможность выделения чистой культуры H. pylori, изучения морфологических, биохимических и биологических свойств микроорганизма, определения антибиотикорезистентности возбудителя [2]. Однако у этого метода существуют и недостатки, к которым относятся: отсроченное получение результатов на 7-10 дней, трудность транспортировки материала для сохранения микроорганизма в жизнеспособном состоянии, высокие требования к условиям культивирования (определенные питательные среды, ограничение доступа кислорода), снижение эффективности выделения H. pylori в случае низкой обсемененности, при отсутствии обострения инфекции и визуальных признаков воспаления. Недостатком данного метода считается его неспособность определять кокковые формы H. pylori [5], тогда как в настоящее время в достаточно высоком проценте случаев у H. pylori-позитивных пациентов в слизистой оболочке желудка преобладают именно кокковые формы возбудителя. В широкой клинической практике данный метод не применяется. В основном он используется в научных целях или при определении резистентности H. pylori к антибиотикам в случае неэффективности терапии первой линии при планировании дальнейшего лечения [6].
Гистологический метод — наиболее объективный метод диагностики H. pylori, ведь используя именно этот метод, Warren и Marshall описали наличие спиралевидной бактерии в слизистой оболочке желудка больных активным хроническим гастритом [7]. Он позволяет обнаружить микроорганизм в гистологических препаратах слизистой оболочки желудка, определить степень обсемененности и расположение микробных тел (поверхностное, внутриэпителиальное), форму микроорганизма (вегетативную или кокковую), а также пути взаимодействия H. pylori с тканями организма человека и наличие морфологических изменений слизистой оболочки желудка, связанных с инвазией микроба (признаки воспаления, атрофия, метаплазия, дисплазия) [8]. В основе метода лежит микроскопическое морфологическое и морфометрическое исследование парафиновых срезов, окрашенных различными способами: гематоксилин-эозином, по Романовскому-Гимзе, генциан-виолетом, по Генту, толуидиновым синим, а также использование иммуногистохимического метода [2, 5]. К преимуществам этого метода диагностики относятся удобство хранения и транспортировки образцов, возможность проведения ретроспективного анализа, проведения оценки взаимосвязи между степенью обсемененности H. pylori и состоянием слизистой оболочки желудка. Недостатками метода являются длительное приготовление парафиновых срезов, некоторая субъективность в определении степени изменения слизистой оболочки желудка, невозможность отдифференцировать виды Helicobacter и тем более их генотип, возможность получения ложнонегативных результатов в связи с неправильным забором гастробиопсийного материала (биопсия только из антрального отдела желудка, скудные биоптаты, не содержащие эпителия и слизи), а также наличия участков кишечной метаплазии, погрешностей окраски [5]. Наряду с собственно гистологическим методом, может использоваться цитологическое исследование мазков со слизистой оболочки желудка, что позволяет существенно уменьшить время получения результатов анализа [2]. Существенное повышение результатов диагностики инфекции достигается при использовании иммуногистохимического метода с моноклональными антителами против H. pylori [9]. Принцип данного метода основан на высокоспецифичном связывании антител к H. pylori, которые в дальнейшем можно визуализировать с помощью химической реакции с антигенами клеточной стенки микроба. В результате прошедшей иммуногистохимической реакции только те бактериальные клетки, которые имеют антигены, специфичные для H. pylori, в том числе и кокковые формы H. pylori, будут иметь характерное окрашивание [5]. К сожалению, широкое использование данного метода ограничено из-за его высокой стоимости и технической сложности [10]. Последним достижением в области гистологического исследования является использование fluorescence in situ hybridization, позволяющий высоко точно и напрямую в залитых в парафин биоптатах определять не только наличие H. pylori, но и штаммов, резистентных к кларитромицину [11].
Молекулярно-генетический метод (полимеразная цепная реакция) является высокочувствительным и специфичным и по диагностической ценности имеет преимущества перед другими методами диагностики H. pylori, включая гистологический и курьтуральный методы [5, 12]. Преимуществами данного метода являются высокая специфичность (обеспечивается подбором праймеров, комплементарных уникальной нуклеотидной последовательности исследуемого микроорганизма), высокая чувствительность (позволяет диагностировать не только острые, но и латентные варианты инфекции, возможно выявление даже единичных бактерий), возможность определения как вегетативных (спиралевидных), так и кокковых форм H. pylori, возможность определения отдельных генов микроорганизма для оценки его патогенности, возможность определения микроорганизма в течение 5-6 часов (экспресс-метод).
Метод состоит из трех этапов: выделение ДНК из клинического образца (биоптата), амплификация специфических фрагментов ДНК, детекция продуктов амплификации. Геном H. pylori содержит около 1600 генов. На сегодняшний день полностью определена нуклеотидная последовательность у двух штаммов микроорганизма: 26695 и J.88 [13, 14]. Существует ряд генов H. pylori, роль которых в продуцировании специфических белков - факторов патогенности микроорганизма - установлена. Именно эти гены — гены острова патогенности H. pylori - определяют при проведении молекулярно-генетического исследования (таблица 2).
Таблица 2
Отдельные гены и факторы патогенности Helicobacter pylori и возможная их роль в патогенезе хеликобактериоза [15 с дополнениями]
|
Ген |
Фактор патогенности (белок) |
Свойства факторов патогенности |
|
cagA |
CagA |
Цитотоксин, маркер «острова патогенности» H. pylori, участвует в ремоделировании тканей, ангиогенезе, язвообразовании, развитии атрофии, в процессе деградации и разрушения межклеточного матрикса и базальной мембраны, опухолевой инвазии и метастазировании посредством индукции комплекса uPA (urokinase-type plasminogen activator) и uPAR (urokinase-type plasminogen activator receptor) в раковые клетки в желудке, стимуляции выработки интерлейкина-8, способствует повышению активности антрального гастрита |
|
cagC, cagE |
CagC, CagЕ |
Цитотоксины, стимулируют выработку интерлейкина-8 |
|
cagH |
CagH |
Цитотоксин, маркер интактного острова патогенности, стимулирует выработку интерлейкина-8 |
|
cagF |
CagF |
Цитотоксин, вовлечен в процесс распознавания и доставки CagA в каналы Т4СС (IV секреторной системы) |
|
vacA |
VacA |
Цитотоксин, фактор адгезии, увеличивает проницаемость мембран по отношению к анионам, достоверно уменьшает скорость реэпителизации экспериментальных язв и пролиферацию эпителиоцитов за счет нарушения функции клетки, связанных с целостностью ее цитоскелета, пассивный транспорт мочевины через эпителиальные клетки желудка, влияет на выживание H. pylori в клетках хозяина, снижает содержание АТФ в эпителиоцитах, стимулирует апоптоз клеток |
|
babA1, babA2 |
BabA1, BabA2 |
Фактор адгезии, рецептор клеток Lewis, предположительно связан с более высокой частотой развития язвенной болезни двенадцатиперстной кишки, осложнений инфекции H. pylori, а также с аденокарциномой желудка (BabA2) |
|
oipA |
OipA |
Поддерживает воспаление СОЖ, связан с секрецией интерлейкина-8 и интерлейкина-6, со степенью обсемененности H. pylori СОЖ, выраженностью нейтрофильной инфильтрацией, с развитием интерстициальной метаплазии |
|
sabA |
SabA |
Поддерживает воспаление, способствует персистенции инфекции H. pylori |
|
iceA1, iceA2 |
IceA1, IceA2 |
Фактор адгезии |
|
flaA,fla B |
FlaA, FlaВ |
Обеспечивают подвижность |
|
ure A, ureB, ure C, ureI |
Уреаза (UreA, UreB, UreC, UreI) |
Является собственно маркером инфекции H. pylori и фактором защиты микроорганизма от действия соляной кислоты, обеспечивает длительное персистирование H. pylori в желудке человека, усиливает воспалительные реакции посредством активации моноцитов, нейтрофилов, секреции цитокинов, образования свободных радикалов и окиси азота. Считается, что большая субъединица уреазы — UreB — действует как аттрактант для лейкоцитов |
|
hopQ, hopP, hopZ |
HopQ, HopP, HopZ |
Обеспечивает колонизацию и обсемененность слизистой оболочки желудка |
|
hpaA |
HpaA |
Фактор адгезии |
|
napA |
NapA |
Активатор окислительного стресса, способен индуцировать процесс освобождения свободных радикалов в нейтрофилах, что приводит к повреждению СОЖ человека |
|
rdxA |
RdxA, FrxA, FdxB |
ферменты окислительного метаболизма, участвуют в формировании резистентности к метронидазолу |
|
23S rRNA |
Точечные мутации A2144G, A2143G, A2143C, A2115C, A2142G, C2182T, T2717C и др. |
участвуют в формировании резистентности к кларитромицину |
|
sodB |
Супероксидисмутаза |
Позволяет H. pylori подавлять иммунный ответ организма хозяина, катализируя реакцию превращения бактерицидных соединений кислорода, высвобождаемых активированными в результате инфекции нейтрофилами, в кислород и воду, являющиеся безвредными для микроба |
|
kat |
Каталаза |
Позволяет H. pylori подавлять иммунный ответ организма хозяина, катализируя реакцию превращения бактерицидных соединений кислорода, высвобождаемых активированными в результате инфекции нейтрофилами, в кислород и воду, являющиеся безвредными для микроба |
Следует заметить, что по данным молекулярно-генетического метода можно косвенно судить о прогнозе заболеваний, ассоциированных с H. pylori. Так, например, если у пациента с язвенной болезнью выявляется микроб, содержащий 1-2 гена острова PAI H. pylori, то с высокой степенью вероятности, прогноз будет благоприятным, с другой стороны, если у молодого практически здорового человека при профилактической фиброгастродуоденоскопии выявляются воспалительно-деструктивные изменения и присутствует H. pylori, содержащий 5-6 генов острова PAI, то прогноз неблагоприятен, если своевременно не провести эрадикационную терапию. Однако не следует забывать, что, согласно Маастрихтскому консенсусу III, различие в штаммах H. pylori, содержащих разное количество и вид генов, не освобождает пациента от прохождения курса антихеликобактерной терапии.
Если говорить о неонвазивных методах диагностики H. pylori, следует уделить особое внимание дыхательным тестам, определению микроорганизма в кале и серологическому методу диагностики.
В основе работы дыхательных тестов лежит биохимический метод определения инфицированности H. pyloriслизистой оболочки желудка по уреазной активности микроорганизма, а именно способности уреазы разлагать мочевину до NH4+ и HCO3- с последующим образованием из HCO3- СО2, который, попадая в кровоток, затем выделяется через легкие и может быть определен в выдыхаемом воздухе. Радиоизотопный уреазный дыхательный тест с мочевиной, меченной радиоактивным углеродом С13 или С14, считается наиболее точным для диагностики H. pylori из неинвазивных методов и известен с 1987 года [16]. Чувствительность и специфичность радиоизотопного уреазного дыхательного теста достигает 90% по данным большинства исследований, однако для данного теста в ряде случаев отмечены ложноположительные результаты по сравнению с гистологическим методом [2]. Вместе с тем способ проведения этого теста до сих пор четко не стандартизирован, а используемые реактивы достаточно дороги [2]. Возможность использования для проведения дыхательного теста детекции паров аммиака (второй метаболит гидролиза мочевины) в воздухе ротовой полости после приема обследуемым мочевины нормального изотопного состава существенно повысила частоту использования дыхательных тестов, т.к. способствовала удешевлению метода, а также повышению его безопасности, поскольку не используются радиоактивные изотопы. Согласно данному принципу в России в 1997 году ООО «АМА» (Санкт-Петербург) разработан «Хелик-тест», показатели которого не зависят от возраста и характера гастродуоденальой патологии, а свидетельствуют лишь о наличии или отсутствии H. pylori [17]. Следует заметить, что дыхательные тесты не рекомендуется проводить больным, получающим антисекреторную терапию во избежание получения ложноотрицательных результатов с учетом возможного взаимодействия соляной кислоты и аммиака [18]. Особенно актуальным считается использование дыхательных тестов у детей в связи с ограничением применения инвазивных методов диагностики H. pylori в детском возрасте.
Для определения H. pylori в кале используется иммуноферментный анализ выявления антигена H. pylori и полимеразная цепная реакция с детекцией генов острова патогенности H. pylori (ureC, cagA). Иммуноферментный анализ выявления антигена H. pylori в кале является высокочувствительным и специфичным методом и признан стандартом в диагностике H. pylori у детей и взрослых как до, так и после проведения эрадикационной терапии. Единственным ограничением широкого применения данного метода является его высокая стоимость по сравнению с другими способами диагностики H. pylori. Полимеразная цепная реакция с детекцией генов острова патогенности H. pylori — относительно новый экспериментальный метод, чувствительность и специфичность которого четко не определены.
Серологический метод диагностики основан на определении антител IgG к H. pylori и IgG к цитотоксину CagA H. pyloriв крови. Данный метод показан для скрининга в популяции, для первичной диагностики инфекции H. pylori, однако мало информативен у детей в связи со слабым иммунным ответом, с помощью этого метода невозможно различить прошедшую или текущую инфекцию, следовательно, он не рекомендован для оценки эффективности эрадикации H. pylori [19, 20]. Согласно многочисленным литературным данным, оценку эффективности эрадикации следует проводить не ранее, чем через 1,5-2 месяца после окончания терапии и отдавать предпочтение неинвазивным методам исследования, если нет необходимости в проведении контрольной фиброгастродуоденоскопии, что особенно актуально в детском возрасте [2, 13, 15, 17, 18].
Как видно из вышеизложенных данных, все методы диагностики H. pylori имеют свои преимущества и недостатки, следовательно, для получения четкого представлены о наличии H. pylori в организме человека необходимо соблюдать следующие правила диагностики:
- Использование 2-х и более методов диагностики H. pylori
- Использование сочетания методов из разных групп: инвазивный+неинвазивный, прямой+непрямой для первичной диагностики H. pylori
- Использование метода ПЦР как наиболее точного для диагностики H. pylori, а также для определения молекулярно-генетических особенностей микроорганизма для оценки его вирулентности, формирования представления о дальнейшем течении и прогнозе заболевания
- Использование для контроля эрадикации H. pylori преимущественно неинвазивных методов не ранее, чем через 1,5-2 месяца после окончания терапии.
При сравнительном анализе эффективности различных методов диагностики H. pylori у взрослых больных H. pylori-ассоциированными заболеваниями, проведенном на кафедре пропедевтики внутренних болезней СПбГМА имени И.И. Мечникова, было установлено, что по данным быстрого уреазного и дыхательного теста H. pylori выявлялся у 100% пациентов, гистологическим методом определялся у 70%, методом ПЦР — у 70% больных. Получение положительных результатов уреазного теста и Хелик-теста при отрицательных — гистологического метода или ПЦР может объясняться не ложноположительными результатами, а тем, что при проведении уреазного и Хелик-теста определяются продукты жизнедеятельности H. pylori, а не сам микроорганизм, который может не попасть в биоптат, исследуемый с помощью гистологического метода или ПЦР. Кроме того, при оценке информативности методов диагностики H. pylori было выявлено, что результаты бактериологического метода в 25% случаев были отрицательными при положительных результатах других методов исследования, что связано со сложностью культивирования H. pylori, следовательно, только на данные бактериологического метода не рекомендуется ориентироваться во избежание ложноотрицательных результатов.
Обращает на себя внимание тот факт, что при проведении ПЦР ген ureC, который традиционно считается маркером наличия инфекции H. pylori, у пациентов Санкт-Петербурга определялся только в 78% случаев, что доказывает высокую изменчивость микроорганизма. Следовательно, необходимо проводить определение не только гена ureC, но и хотя бы еще одного часто встречающегося гена H. pylori, например, гена cagA или ureI, что уже внедрено в практику в некоторых европейских странах.
Также нами была проведена сравнительная оценка результатов различных методов выявления инфекции H. pylori с последующей разработкой алгоритма оптимизации диагностики хеликобактериоза.
Для этого было обследовано 135 пациентов от 17 до 72 лет с патологией верхних отделов пищеварительного тракта (37% больных язвенной болезнью, 63% - с хроническим гастродуоденитом). Пациентам проводилась фиброгастродуоденоскопия с взятием биоптатов из тела и антрального отдела желудка для верификации H. pyloriследующими методами: быстрый уреазный тест, «Хелик-тест», гистологическое исследование, полимеразная цепная реакция (ПЦР) с детекцией ureC и cagA генов острова патогенности микроорганизма, бактериологическое исследование (посев биоптатов слизистой оболочки желудка для выявления роста H. pylori).
При сравнении полученных результатов было установлено, что максимальное количество положительных результатов определялось при использовании быстрого уреазного теста, минимальное количество — при посеве биоптатов (рисунок 1). 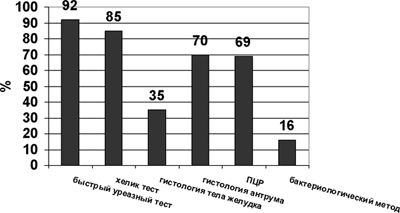
Рис. 1. Сравнительная характеристика результатов различных методов диагностики H. pylori
По оси абсцисс — методы исследования
По оси ординат — количество положительных результатов, %
Кроме того, нами был проведен корреляционный анализ в отношении совпадения показателей различных методов диагностики, на основании которого установлена корреляционная связь между результатами быстрого уреазного теста и ПЦР (ген ureC) (рисунок 2), быстрого уреазного теста и гистологического исследования (H. pylori в теле желудка) (рисунок 3), «Хелик-теста» и гистологического исследования (H. pylori в теле желудка) (рисунок 4). На основании этого можно утверждать. Что использование комбинаций этих методов будет наиболее информативно для диагностики инфекции. 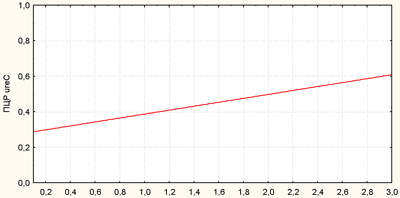
Рис. 2. Корреляционная связь между результатами быстрого уреазного теста и ПЦР (ген ureC)
По оси абсцисс — результаты быстрого уреазного теста, баллы 0-3,
По оси ординат — результаты ПЦР (ген ureC) (0—отрицательный, 1—положительный) 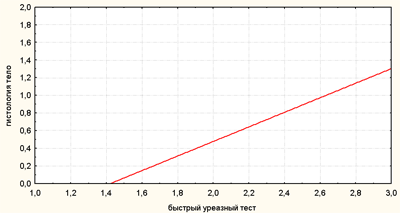
Рис. 3. Корреляционная связь между результатами быстрого уреазного теста и гистологического исследования (H. pylori в теле желудка)
По оси абсцисс — результаты быстрого уреазного теста, баллы 0-3
По оси ординат — результаты гистологического исследования (H. pylori в теле желудка), (0-отрицательный, 1—положительный) 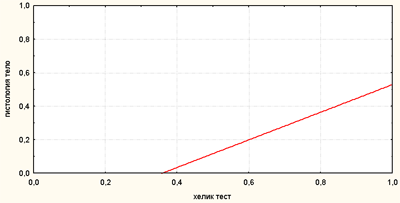
Рис. 4. Корреляционная связь между результатами «Хелик-теста» и гистологического исследования (H. pylori в теле желудка)
По оси абсцисс — результаты «Хелик-теста», (0—отрицательный, 1—положительный)
По оси ординат — результаты гистологического исследования (H. pylori в теле желудка), (0—отрицательный, 1—положительный)
На основании полученных данных нами были сделаны следующие выводы разработаны рекомендации:
- Получение положительных результатов уреазного теста и «Хелик-теста» при отрицательных — гистологического метода или ПЦР может объясняться не ложноположительными результатами, а тем, что при проведении уреазного и «Хелик-теста» определяются продукты жизнедеятельности H. pylori, а не сам микроорганизм, который может не попасть в биоптат, исследуемый с помощью гистологического метода или ПЦР.
- «Хелик-тест» рекомендуется как точный неинвазивный метод при проведении оценки эффективности эрадикационной терапии, особенно в детском возрасте.
- Для повышения точности диагностики хеликобактериоза рекомендуется использовать как минимум два, а лучше три, метода исследования, предпочтительно сочетание быстрого уреазного теста или «Хелик-теста» с гистологическим методом исследования (биоптат из тела желудка) или ПЦР (детекция гена ureC).
Диагностика Helicobacter pylori
Обязательными тестами для определения Helicobacter pylori являются гистологический и уреазный.
Цитологическое исследование
Для цитологического исследования используются мазки-отпечатки (1-2 и более), полученные при эндоскопии из биоптатов слизистой оболочки (СО) антрального отдела желудка. Биоптат берется прицельно из участков с наиболее выраженными визуальными отклонениями от нормы (гиперемия, отек), но не из дна язв и эрозий. Высушенные мазки окрашиваются.
Применяемые паноптические методы окраски позволяют выявить морфологические особенности строения ядер и цитоплазмы клеток слизистой оболочки, наличие Helicobacter pylori, ориентировочно оценить количество микроорганизмов. Как правило, НР располагаются в слизи, имеют спиралевидную, изогнутую форму, могут быть S-образными. иметь вид «крыльев летящей чайки».
При изучении в цитологических препаратах можно выделить три степени обсеменённости слизистой оболочки: слабая {+) — до 20. средняя (++) — до 40, высокая (+++) — более 40 микробных тел в поле зрения при увеличении х360.
При обнаружении в мазках-отпечатках Helicobacter pylori выявляется также и клеточная инфильтрация, характеризующаяся наличием лимфоцитов, плазматических клеток, нейтрофилией и эозинофилией.
По преобладанию тех или иных клеточных элементов можно косвенно судить об активности и выраженности воспаления, кроме того, цитологическое исследование позволяет выявить в клетках слизистой оболочки наличие пролиферативных процессов и слепень их выраженности, метаплазии (кишечной в желудке и желудочной в дуоденуме), дисплазии и её степени тяжести, злокачественного новообразования. Однако цитологический метод не дает информации о структуре исследуемой слизистой оболочки.
Уреазный тест
По скорости выявления персистирующей Helicobacter pylori в слизистой оболочке цитологическому не уступает уреазный экспресс-метод, основанный на уреазной активности Helicobacter pylori. Teст состоит из геля-носителя, содержащего мочевину, бактериостатический агент и фенол-рол в качестве индикатора рН. Индикатор меняет цвет от желтого к малиновому, когда под действием уреазы происходит гидролиз мочевины с образованием аммиака, сдвигающего рН среды в щелочную сторону. Биоптат слизистой оболочки, полученный при эндоскопии, помещают в тест, Малиновое окрашивание теста, наступившее вслед за этим, свидетельствует о наличии в биоптате Helicobacter pylori. Изменение цвета среды происходит только в том случае, если в биоптате присутствует уреаза, выделенная Helicobacter pylori. Время изменения окраски теста косвенно свидетельствует о количестве жизнеспособных бактерий. Появление малинового окрашивания в течение первого часа соответствует значительной инфицированности слизистой оболочки Helicobacter pylori (+++), в течение последующих двух часов— умеренной (++), к концу суток - незначительной (+). Если же окрашивание наступает в более поздние сроки — результат считается отрицательным
Ложноотрицательные результаты имеют место у больных при слабой обсемененности слизистой оболочки. Ложные результаты исключаются при правильной обработке эндоскопов и биопсийных щипцов, Для повышения достоверности диагностики геликобактериоза рекомендуется сочетание обоих, гистологического и уреазного, методов, особенно важно их проведение не ранее чем через четыре недели после окончания антибактериального лечения, так как наличие персистирующей инфекции является основанием к проведению повторного курса комбинированной антигеликобактерной терапии.
Существует немало модификаций уреазного геста, и любой из них может оказаться полезным для диагностики геликобактериоза (например, ускоренный де-нол-тест фирмы «Яманучи Юроп», CLO-тест, Австралия, и др.).
13С уреазный дыхательный тест
Метод неинвазивен, абсолютно безопасен, позволяет определять степень колонизации слизистой оболочки желудка Helicobacter pylori и является оптимальным для контроля эрадикационной терапии. Исследование проводится натощак, Вначале в пластиковые пробирки с интервалами в 1 мин берутся две фоновые пробы выдыхаемого воздуха. Затем принимается внутрь легкий пробный завтрак (молоко, сок и др.) и тестовый субстрат (водный раствор мочевины, меченной 13С ). В последующем в течение часа через 15 мин берутся четыре пробы выдыхаемого воздуха.
Содержание стабилизированного изотопа в выдыхаемом воздухе определяется с помощью масс-спектрометра, В соответствии с этим рассматриваются 4 степени инфицированности Helicobacter pylori: легкая — менее 3.5%, средняя — 3,5-6,4%, тяжелая — 6,5-9.4%, крайне тяжелая — более 9,5%. В норме содержание стабилизированного изотопа 13С не превышает 1% общего количества С02 в выдыхаемом воздухе.
Дополнительные методы диагностики Helicobacter pylori
Микробиологический метод.
Материалом исследования для микробиологической диагностики Helicobacter pylori являются биоптаты из слизистой оболочки желудка или двенадцатиперстной кишки, полученной в условиях максимальной стерильности. Инкубация посевов осуществляется я в микроаэрофильных условиях при содержании кислорода не более 5%. Такие условия создаются путем заполнения герметически закрывающихся сосудов газовой смесью (5% кислорода, 10% углекислого газа, 85% азота), при использовании специальных газогенераторных химических пакетов. На кровяной питательной среде геликобактер на 3-5 сут. формирует мелкие круглые, гладкие, прозрачные, росинчатые колонии диаметром 1—3 мм,
В дальнейшем проводится идентификация выделенных культур, определяются их морфологические, тинкториальные свойства, чувствительность к антибиотикам, подвижность и приводятся другие специальные исследования в зависимости от возможностей и задач, стоящих перед исследователем. Воспользоваться этим методом в условиях обычной лаборатории довольно трудно.
Гистологические методы
Гистологические методы получили широкое распространение, так как позволяют быстро обнаружить Helicobacter pylori в биоптатах и одновременно изумить морфологические изменения в слизистой оболочке. Наиболее простым и доступным метолом выявления Helicobacter pylori является окраска по Гимзе без дифференцировки. Helicobacter pylori при этом окрашиваются в темно-синий цвет, они хорошо видны как на поверхности эпителия, так и в глубине ямок. Для оценки состояния слизистой оболочки и обнаружения Helicobacter pylori достаточно двух биоптатов.
Материалом может служить любой участок слизистой оболочки желудка и двенадцатиперстной кишки, но при этом обязательно следует исследовать прицельно взятые биоптаты из антрального отдела в 2—3 см от привратника из участка визуально более выраженного воспаления (гиперемия, отёк). но не из дна эрозии и язвы. Частота выявления Helicobacter pylori с помощью гистологического метода хорошо корригирует с другими методами и составляет не менее 75-80%, Результативность метода зависит от многих факторов, в том числе и от способа приготовления и окраски препарата, В последнее время разработаны новые методы, среди которых наиболее чувствителен им муноцитохимический с применением моноклональных антител и комплекса авидин-биотин-пироксидазы.
Весьма обнадеживающие результаты получены при выявлении Helicobacter pylori методом гибридизации ДНК в обычных парафиновых срезах. Методика не только чувствительна, но и высокоспецифична, с ее помощью можно идентифицировать различные штаммы геликобактера и понять природу повторного обнаружения Helicobacter pylori после успешного лечения (новая ли это инфекция или размножение сохранившихся бактерий).
Иммунологические методы.
У всех больных, инфицированных Helicobacter pylori, в слизистой оболочке желудка и соответственно в двенадцатиперстной кишке образуются антитела. Специфический гуморальный иммунный ответ против антигенов геликобактера отчетливо регистрируется через 3—4 недели после инфицирования. Антитела могут быть определены различными методами (в реакции преципитации и др.), но наибольшее значение имеет метод иммуноферментного анализа (ИФА). Этим тестом выявляются антитела IgG, IgA, IgM классов в сыворотке крови, а также секреторные IgA. IgM в слюне и содержимом желудка. В практике используют ИФА по определению IgG и реже IgA-антител в сыворотке крови.
Этот метод в основном используется с целью выявления инфицированности больных с гастродуоденальной патологией и контроля эффективности антибактериального лечения в отдаленные сроки наблюдения. Преимущество метода состоит в том, что он выявляет факт инфицирования не только при манифестных, но и при субклинических формах, а также в стадии ремиссии заболевания. Следует также иметь в виду, что тест остается положительным еще не менее месяца после успешной ликвидации Helicobacter pylori, а на ранней стадии, в течение 2—3 недель с момента инфицирования, тест оказывается отрицательным.
В настоящее время в практику внедряются более совершенные методы определения Helicobacter pylori: полимеразная цепная реакция (ПЦР), определение антигена в кале и др.
Хеликобактер пилори — это бактерия, которая обнаруживается у пациентов с заболеваниями желудка и двенадцатиперстной кишки.
Название бактерии хеликобактер пилори происходит от «пилори», указывающего на главное место обитания — пилорический отдел желудка, и «хелико», которое дает характеристику формы бактерии: винтообразный, спиралевидный.
Авторы этого открытия доктор Барри Маршал и Робин Уоррен получили престижную нобелевскую премию в области медицины в 2005 году. Открытие хеликобактер пилори стало революционным по трем причинам:
Было установлено, что бактерия может выживать в кислой среде желудка, что ранее считалось невозможным, а также является причиной большинства заболеваний желудка. Прием антибиотиков в составе терапии может вылечить или предотвратить многие болезни желудка.
Первая особенность хеликобактер пилори заключается в противостоянии чрезвычайно кислой среде желудка. Благодаря высокой кислотности, большинство бактерий и вирусов гибнут в желудке. Хеликобактер сопротивляется кислотности с помощью двух механизмов:
- c момента попадания в желудок, бактерия, благодаря своим жгутикам, может перемещаться и скрываться в слизи, которая покрывает стенки желудка и защищает клетки.
- кроме того, хеликобактер усиливает защитную секрецию аммиака, нейтрализующего кислую среду желудка.
Таким образом, бактерия закрепляется на стенке желудка и может там оставаться в течение многих десятилетий.
Вторая особенность хеликобактер пилори заключается в том, что бактерия является причиной болезней желудка и двенадцатиперстной кишки.
По большому счету, размножаясь, бактерия способна разрушать клетки нашего желудка. А именно, высвобождение вредных веществ вызывает хронические воспаления и приводит к гастриту.
Ослабление слизистой оболочки желудка или двенадцатиперстной кишки способствует появлению язвы и повышает риск развития рака желудка. На сегодня известно, что хеликобактер является главной причиной рака желудка.
Третья особенность хеликобактер пилори заключатся в ее уничтожении посредством курса лечения с применением антибиотиков и лекарственных средств, регулирующих уровень кислотности. Сегодня мы можем сказать, что у людей, страдающих заболеваниями желудка, есть три веские причины провериться на наличие хеликобактер пилори.
- Эта бактерия очень устойчива к кислой среде желудка и может обитать в ней на протяжении многих лет.
- Хеликобактер пилори влечет за собой иногда очень серьезные заболевания.
- Эффективное лечение позволяет предотвратить болезни и их осложнения.
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ
Какой именно метод выбрать для первичной диагностики инфекции, зависит от конкретной клинической ситуации, возможностей лечебного учреждения, состояния пациента. Полученные результаты во многом зависят от соблюдения правил забора биологического материала, условий и сроков его хранения, консервации и транспортировки в лабораторию для каждого конкретного исследования. Даже при соблюдении этих правил, каждый из методов имеет свои пределы диагностических возможностей, которые отражены в их основных рабочих характеристиках. Точность метода определяется его чувствительностью (инфекция диагностируется, когда она есть) чем она выше, тем меньше процент ложноположительных результатов и специфичностью (инфекция не диагностируется, когда ее нет) чем она выше, тем меньше процент ложноотрицательных результатов.
Если имеются показания к проведению диагностической эндоскопии (язвенная болезнь желудка, язвенное кровотечение, геморрагический гастрит, новообразования желудка и др.), то на фоне прицельной биопсия слизистой оболочки из преддверия привратника (из одного участка) и тела (из двух участков - передняя и задняя стенки) желудка - наиболее предпочтительными методами для выявления Helicobacter pylori считаются:
•проведение гистологического исследования - фиксация и окраска препаратов для гистологического исследования обычно занимают несколько дней
•определение уреазной активности (ускоренные уреазные тесты) - оценка результата уреазного теста занимает несколько часов
По особым показаниям могут быть проведены (перечисленные исследования являются трудоемкими, дорогостоящими и пока еще используются редко):
•посев бактериальной культуры
•полимеразная цепная реакция (ПЦР)
•уреазный дыхательный тест
Если диагноз, например язвенная болезнь желудка, был установлен ранее, во время эзофагогастродуоденоскопии, то методом выбора для выявления инфицирования слизистой оболочки желудка Helicobacter pylori могут быть (данные методы неинвазивны и достаточно точны):
•серологический (иммунологический) тест
•уреазный дыхательный тест
МЕТОДЫ ДИАГНОСТИКИ Helicobacter pylori
Наиболее распространенными из них являются цитологический, уреазный и гистологический методы.
ЦИТОЛОГИЧЕСКИЙ метод исследования
Материалом для цитологического исследования служат мазки-отпечатки биоптатов, полученные при эндоскопии из участков слизистой оболочки антрального отдела желудка или двенадцатиперстной кишки с наиболее выраженными морфологическими изменениями (гиперемия, отек и т.п.). Мазки высушивают и окрашивают по Романовскому-Гимзе, по Папенгейму или метанолазурэозиновой смесью. Микроскопия окрашенных мазков-отпечатков позволяет выявить наличие Helicobacter pylori и ориентировочно оценить количество микроорганизмов.
Выделяют три степени обсемененности слизистой оболочки:
I.слабая (+) - до 20 микробных тел в поле зрения
II.средняя (++) - от 20 до 40 микробных тел в поле зрения
III.высокая (+++) - более 40 микробных тел в поле зрения
УРЕАЗНЫЙ ДЫХАТЕЛЬНЫЙ тест
В развитых странах в последние годы стандартным методом контроля за эрадикацией стал уреазный дыхательный тест, который основан на способности уреазы разлагать мочевину до НСО3 ¯ и NH4 +. Из НСО3¯ образуется СО2, который, попадая в кровоток, затем транспортируется в легкие. Для проведения УДТ необходима мочевина, меченная радиоактивным углеродом ¹³С или 14С. Чаще в клинической практике применяется нерадиоакивный стабильный углерод ¹³С. 14С используется реже, так как является источником излучения низкоэнергетических β-частиц, которые обнаруживаются сцинтилляционным счетчиком. Изотоп количественно определяют газовым хроматомасс-спектрометром или с помощью инфракрасного и лазерного оборудования.
В начале исследования берутся 2 фоновые пробы выдыхаемого воздуха. Далее пациент съедает легкий завтрак и тестовый субстрат; в течение 1 часа, с интервалами в 15 минут, у него берут 4 пробы выдыхаемого воздуха. Уровень радиоактивного изотопа в выдыхаемом воздухе определяют в течение 10-30 минут. Затем пробирки направляются на масс-спектрометрию. Результат выражается как приращение ¹³СО2 – δ¹³СО 2, его экскреция (‰) и считается положительной при значениях выше 5‰.
В ряде стран используется определение изотопного отношения концентраций ¹³СО2/¹²СО2, что позволяет свести к минимуму влияние на конечный результат методических и инструментальных погрешностей.
При использовании дыхательного уреазного теста ложноположительные результаты считаются редкими (4-10%), ложноотрицаельные результаты возможны у пациентов, принимавших перед исследованием антисекреторные и висмутсодержащие препараты, которые ингибируют уреазу бактерий, в связи с чем рекомендуется осуществлять диагностику эрадикации уреазными методами не ранее чем через месяц после приема этих препаратов.
Метод быстрый, удобный, но ограничен в распространении из-за необходимости использовать дорогостоящее оборудование и изотопные препараты. Поскольку уменьшение стоимости изотопа невозможно, были предложены варианты масс-спектрометров на основе лазерного и инфракрасного излучения, стоимость которых существенно ниже. С другой стороны, использование микрокапсул для упаковки мочевины, меченной радиоактивным изотопом, позволило свести к минимуму трудности, связанные с хранением, утилизацией и безопасностью данного изотопа. В США продажа микрокапсул с мочевиной, меченной углеродом, разрешена FDA наравне с обычными лекарственными препаратами через аптечную сеть, что является свидетельством полной безопасности данного изотопа для обследуемых и окружающей среды. Появление такой формы меченной мочевины существенно повышает конкурентноспособность этой методики, т.к. стоимость и самого изотопа, и оборудования для его проведения в среднем меньше в 10 раз, чем масс-спектрометра.
БЫСТРЫЙ УРЕАЗНЫЙ тест
Уреазный тест («кампи-тест») относится к числу экспресс-методов выявления Helicobacter pylori.
Стандартный «кампи-тест» состоит из:
•содержащего мочевину геля-носителя
•раствора азида натрия
•раствора фенол-рота - используется в качестве индикатора рН, который при сдвиге рН среды в щелочную сторону меняет свой цвет от желтого к малиновому; сдвиг рН происходит в том случае, если под действием хеликобактерной уреазы происходит гидролиз мочевины с образованием аммиака
В качестве источника хеликобактерной уреазы используют биоптаты слизистой оболочки, которые помещают в луночку специальной плашки из синтетического материала, заполненную готовой стерильной средой.
Появление малинового окрашивания теста свидетельствует о наличии в биоптате микробных тел Helicobacter pylori.
О количестве Helicobacter pylori в биоптате косвенно судят по времени изменения окраски теста:
•значительное инфицирование слизистой оболочки НР (+++) - малиновая окраска теста появляется в течение 1 часа от начала исследования
•умеренное инфицирование слизистой оболочки НР (++) - окраска индикатора изменяется через 2–3 часа
•незначительное инфицирование слизистой оболочки НР (+) - малиновое окрашивание теста появляется к концу суток
Более позднее окрашивание теста относят к отрицательным результатам.
При проведении уреазного теста нужно учитывать и тот факт, что он может быть положительным у лиц, желудок которых колонизирован Helicobacter heilmanii, имеющим близкое сродство с Helicobacter pylori.
ГИСТОЛОГИЧЕСКИЕ методы ("золотой стандарт" диагностики)
Данные методы методы исследования биоптатов, наряду с возможностью детального изучения морфологических изменений в слизистой оболочке желудка и двенадцатиперстной кишки, позволяют выявить Helicobacter pylori при обычной окраске по Романовскому–Гимзе. При эндоскопии биоптаты берут прицельно из антрального отдела желудка в 2–3 см от привратника и из участка с наиболее выраженными воспалительными изменениями слизистой.
Различные новые модификации этого метода, в частности, иммуноцитохимический метод с применением моноклональных антител или метод гибридизации ДНК, дают возможность не только существенно повысить чувствительность и специфичность гистологического выявления Helicobacter pylori, но и идентифицировать различные штаммы Helicobacter pylori, что важно для выяснения природы повторного инфицирования слизистой оболочки после эффективного антихеликобактерного лечения.
ФАЗОВО-КОНТРАСТНАЯ микроскопия
Helicobacter pylori может быть обнаружен до микробиологического или гистологического исследования при помощи фазово-контрастной микроскопии. Этот метод весьма удобен для обнаружения Helicobacter pylori, при условии достаточно высокой степени обсеменения.
Преимущества фазово-контрастной микроскопии:
•нет необходимости проводить фиксацию материала и дополнительных окрасок ткани
•исследование можно проводить в обычных лабораторных условиях
•результат может быть получен через 1-2 мин.
Процедура выполнения исследования:
•поместить биоптат на предметное стекло
•измельчить биоптат на стекле и добавить каплю физиологического расвора
•поместить на измельченный биоптат покровное стекло
•оместить приготовленный препарат в фазово-контрастный микроскоп
Микроскопия проводится с увеличением в 100 раз с спользованием иммерсионного масла. В препарате - типичные изогнутые бактерии в хаотичном движении.
ИММУНОЛОГИЧЕСКИЕ методы
Иммунологические методы основаны на выявлении у больных, инфицированных Helicobacter pylori, специфических антител, которые можно обнаружить в сыворотке крови уже через 3–4 недели после инфицирования. Достаточно высокий титр антител сохраняется даже в периоде клинической ремиссии заболевания. Отрицательным тест становится после успешного антибактериального лечения, что позволяет использовать метод для контроля эффективности такой терапии. Для выявления специфических антител используют различные методики, в частности, метод иммуноферментного анализа (ИФА) с определением антител IgG и IgA классов в сыворотке крови.
При оценке результатов иммунологического анализа следует помнить, что антитела к различным антигенам бактерии могут присутствовать в крови на протяжении года после эрадикации бактерий, что не позволяет применять методы для контроля результатов антигеликобактерного лечения.
Иммуногистохимический метод
Биопсийный материал, фиксированный в формалине и залитый в парафин, обрабатывается моноклональными антителами против Helicobacter pylori. Готовые к применению коммерческие наборы с моноклональными антителами работают при разведении 1:200000 и избирательно окрашивают только Helicobacter pylori. Этот метод хорошо зарекомендовал себя при исключительно низкой степени обсемененности слизистой оболочки желудка Helicobacter pylori, когда морфологический метод и уреазный тест дают ложноотрицательные или сомнительные результаты. Он также используется для выявления морфологически измененных (кокковых форм) Helicobacter pylori.
БАКТЕРИОЛОГИЧЕСКИЙ метод
Наибольшую информацию о Helicobacter pylori возможно получить только при выделении его из прижизненных биопсийных образцов. Это единственный метод исследования, обладающий 100% специфичностью. При этом виде исследования возможно не только выделение чистой культуры Helicobacter pylori и ее идентификация, но и изучение морфологических, биохимических и биологических свойств возбудителя.
Бактериологический метод исследования дает возможность определять антибиотикорезистентность у Helicobacter pylori и проводить за ней динамические наблюдения. Без бактериологического метода планировать клиническое испытание лекарственных препаратов, учитывая причины неудачи эрадикации, нельзя, так как основная причина, снижающая процент эрадикации – антибиотикорезистентность Helicobacter pylori.
В эпидемиологической практике выделение чистой культуры Helicobacter pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием, которое может быть обусловлено тем же штаммом.
В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Helicobacter pylori, изготовлять препараты для серологической диагностики, создать банк штаммовдля эпидемиологических и других исследований, так как штаммы бактерии в замороженном виде при температуре -70°С могут храниться в течение 5-7 лет. Без этого метода невозможно дальнейшее научное изучение микроорганизма. Однако этот метод достаточно дорогой. Кроме того, он сопряжен с определенными трудностями, обусловленными необходимостью наличия специальных сред, оптимальной температуры, влажности, качества атмосферного воздуха и т.д. Это приводит к тому, что рост колоний микроорганизмов удается получить далеко не всегда. Неудобство метода связано и с тем, что его результатов приходится ждать, как правило, не менее 10-14дней. В клинической практике он применяется в основном вслучаях инфекции Helicobacter pylori, резистентной к обычным схемам антигеликобактерной терапии.
Helicobacter pylori крайне «капризен», требует специальных условий культивирования и дорогостоящего оборудования. Большой шаг вперед в успешном культивировании Helicobacter pylori принадлежит транспортным средам, которые дают возможность продлить сроктранспортировки биоптата из эндоскопического кабинета вмикробиологическую лабораторию до суток (среды Стюарта, Кэри-Блэйера, Био Мерьо).
Посевы инкубируются при температуре 37°С, влажности 98%, в микроаэрофильных условиях в течение 3-10 сут. Helicobacter pylori растет в атмосфере, содержащей 5% кислорода, 5-10% углекислого газа, остальное составляет азот. Для данного микроорганизма губительны как анаэробные условия, так и более высокое содержание кислорода. Для создания микроаэрофильной атмосферы используют газогенераторные пакеты, которые продуцируют газовые смеси после добавления в них воды. Оптимальный рост колоний наблюдают при рН среды от 6,7 до 8,0. Многие штаммы Helicobacter pylori могут расти и развиваться в достаточно широком диапазоне температур при +32°С... +39°С, но не растут при +27°С ...+42°С. Время инкубации: первичное исследование – 7 дней, контроль лечения - 14 дней.
На неселективной питательной среде Helicobacter pylori на 3-5 сутки при первичном посеве и на 2 сутки при пересевах чистой культуры формирует мелкие, круглые, гладкие, прозрачные, росинчатые колонии диаметром 1-3 мм. На селективной питательной среде колонии Helicobacter pylori приобретают характерное золотисто-желтое окрашивание, за счет присутствующего в этой среде трифенилтетразолий хлорида. При появлении колоний, сходных по морфологии с Helicobacter pylori (диаметром до 0,5 – 2 мм в виде «капель росы» или при сплошном росте, образующие прозрачную пленку), происходит их идентификация. Предложена методика полуколичественного определения обсеменения слизистой оболочки желудка в зависимости от числа выросших микробных колоний: до 10 колоний в чашке (1+), 10-20 колоний (2+), 20-50 колоний (3+), более 50 колоний (4+).
Для идентификации мазки окрашивают по Граму. Под микроскопом в случае Helicobacter pylori обнаруживают грамотрицательные изогнутые палочки. Проводят биохимическое типирование – уреазная, каталазная, оксидазная активность, Helicobacter pylori не ферментирует глюкозу, не продуцирует нитраты, не образует индол.
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
Метод предназначен для качественного обнаружения ДНК Helicobacter pylori в биологических образцах (биоптаты антрального отдела желудка, биоптаты двенадцатиперстной кишки, биоптаты десен, мазки из зубодесневого кармана, слюна.). Позволяет оценить генотипические и фенотипические характеристики возбудителя. Почти у каждого пациента имеется уникальный штамм Helicobacter pylori. Выявлено, что вирулентность Helicobacter pylori во многом обусловливает клинические проявления инфекции. Существует ряд генов, продукты которых – белки Cag A, Vac A, Ice A, Bab A – полагают факторами патогенности. В зависимости от их наличия выделяютдва типа штаммов Helicobacter pylori. Экспрессирующие Cag A- и Vac A-токсин относятся к первому типу, штаммы второго типа не экспрессируют указанные гены и считаются менее патогенными. Среди большого многообразия гибридизационных методов анализа ДНК, метод ПЦР наиболее широко используется в клинической лабораторной диагностике.
ПЦР (относится к молекулярно-биологическим методам) представляет собой многократное увеличение числа копий (амплификация) специфического участка ДНК катализируемое ферментом ДНК-полимеразой.
Метод ПЦР в средах позволяет идентифицировать Helicobacter pylori без выделения чистой культуры по присутствующим в исследуемом материале фрагментам его генома.
В основе метода ПЦР лежит природный процесс - комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы. Эта реакция носит название репликации ДНК. Данный процесс можно использовать для получения копий коротких участков ДНК, специфичных для конкретных микроорганизмов, т.е. осуществлять целенаправленный поиск таких специфических участков, что и является целью генодиагностики для выявления возбудителей инфекционных заболеваний.
Записаться на консультацию можно по телефону: +7 (495) 681-23-45. Ознакомиться с ценами на прием, а также узнать стоимость других процедур вы можете в разделе "Цены" нашего сайта.